Эти руководящие указания рассматривают оценку и анализ систем высокочистой воды, используемых в производстве лекарственных препаратов и субстанций, главным образом с точки зрения микробиологических аспектов. Также, руководящие указания включают обзор различных типов систем, используемых в практике, и проблем, присущих каждой из них. Как и другие руководящие указания, они не являются исчерпывающими, а содержат основу и методологические принципы проверки и оценки систем высокочистой воды. Дополнительные рекомендации можно найти в руководящих указаниях по инспектированию фармацевтических лабораторий контроля качества (май 1993 г.).
-
Проектирование системы
Одним из основных факторов, оказывающих влияние на проектирование системы получения высокочистой воды, является тип продукта, который будет производиться. Например, для парентеральных препаратов, где основной проблемой является пирогенность, используется только вода для инъекций (ВДИ). Она применяется как для приготовления лекарственных препаратов, так и для финального ополаскивания компонентов первичной упаковки и оборудования, используемых при их производстве. Единственными разрешенными Фармакопеей США методами получения ВДИ являются дистилляция и обратный осмос. Однако при производстве фармацевтических и биотехнологических продуктов в форме in bulk, а также в некоторых зарубежных компаниях, для минимизации содержания эндотоксинов в лекарственных субстанциях, вводимых парентерально, допускается использование ультрафильтрации.
При приготовлении некоторых офтальмологических продуктов, таких как офтальмологические растворы для ирригаций, и некоторых других ингаляционных продуктов, таких как стерильная вода для ингаляций, должна использоваться вода для инъекций. Однако при приготовлении большинства ингаляционных и офтальмологических препаратов на практике используется вода очищенная. Это также относится к производству местнодействующих, косметических и пероральных препаратов.
Другим, не менее важным параметром, который необходимо учитывать при проектировании систем, является температура воды. Системы хранения и распределения воды для фармацевтических целей в горячем состоянии (65–80°С) считаются самосанирующимися. Хотя стоимость других систем для предприятия может оказаться гораздо ниже по сравнению с данным типом исполнения, в конечном счете, затраты на обслуживание, проведение анализов и потенциальных проблем могут превысить стоимость сэкономленной энергии. Также важно, является ли система циркуляционной или однонаправленной. Очевидно, что в постоянно движущейся воде сильное загрязнение менее вероятно. В то время как однонаправленная система в принципе является тупиковой.
И наконец, возможно, самым важным аспектом проектирования систем высокочистой воды является оценка риска или уровень качества продукта, который необходимо получить. Следует понимать, что для различных продуктов нужна вода разного качества. Для парентеральных препаратов нужна очень чистая вода без эндотоксинов. Для местнодействующих и пероральных препаратов требуется вода более низкого качества, для них отсутствуют требования по содержанию эндотоксинов. Даже в случае местнодействующих и пероральных препаратов есть факторы, которые определяют выбор воды различного качества. Например, консерванты в антацидных препаратах имеют минимальную эффективность, поэтому для таких препаратов необходимы более жесткие требования по микробиологической чистоте. В данном случае Отделу контроля качества (ОКК) следует проверять каждый продукт, производимый с испольованием воды из системы, и определить для нее так называемый «Порог корректирующих действий» (Action limit) по показателю «Микробиологическая чистота», исходя из наиболее микробиологически чувствительного продукта. Вместо жестких пределов корректирующего действия, установленных к качеству воды, предприятие может включить в процесс производства чувствительных продукта(-ов) стадии снижения микробиологической нагрузки.
-
Валидация системы
Основным документом, который используется для валидации систем высокочистой воды, является Технический Отчет PDA (Parenteral Drug Association – Ассоциация парентеральных препаратов) № 4 «Проектные концепции для валидации систем получения воды для инъекций».
Во введении к этому документу приводятся методические рекомендации и указывается, что «Валидация часто предполагает применение метода контрольного загрязнения и проведение соответствующих испытаний. В этой ситуации было бы нежелательно привносить микроорганизмы в работающую систему, поэтому остается рассчитывать на периодический микробиологический контроль и установку оборудования для мониторинга в определенных контрольных точках, чтобы убедиться в том, что вся система работает надлежащим образом и постоянно выполняет предусмотренную функцию».
При рассмотрении валидационного отчета или при валидации системы высокочистой воды следует обращать внимание на ряд аспектов. Документация должна включать описание системы и ее схему. На чертеже должны быть показаны все входящие в систему единицы оборудования от точки подачи исходной воды до точек ее потребления. Здесь же следует указать и все точки отбора проб с их обозначениями. Отсутствие схемы системы водоподготовки обычно считается неприемлемым. При этом размышляют так: «Если нет схемы системы, как можно ее валидировать? Как работник ОКК или микробиолог узнает, где отбирать пробы?» На предприятиях, с отсутствующими актуальными схемами, были выявлены серьезные проблемы. Чертежи должны быть скорректированы с реально существующей схемой для подтверждения ее правильности и актуальности, выявления незарегистрированных изменений и подтверждения зарегистрированных изменений.
Убедившись, что все оборудование и трубопроводы смонтированы надлежащим образом и работают в соответствии с заданными параметрами, можно приступать к начальной фазе валидации системы высокочистой воды. На этом этапе определяются эксплуатационные параметры системы, а также процедуры и периодичность очистки/дезинфекции.
В течение двух–четырех недель следует ежедневно отбирать пробы после каждого этапа процесса очистки и в каждой точке потребления. Процедура отбора пробы в точке потребления должна быть выполнена в полном соответствии тому, как отбирается вода в этой конкретной точке, т.е., если обычно в работе используется шланг, пробу нужно брать из конца шланга. Если в соответствии со стандартной операционной процедурой (СОП) перед использованием воды из данной точки требуется промывка линии сильной струей, пробу отбирают после такой промывки. К концу этих двух–четырех недель предприятие должно разработать комплект СОП по эксплуатации системы высокочистой воды.
Вторая фаза валидации системы заключается в подтверждении того, что при эксплуатации в соответствии с СОП система способна стабильно производить воду надлежащего качества. На этом этапе пробы отбирают так же, как и на начальной фазе валидации. По завершении данной фазы полученные данные должны демонстрировать, что система будет стабильно производить воду требуемого качества.
Третья фаза валидации призвана продемонстрировать, что при длительной эксплуатации системы высокочистой воды в соответствии с утвержденными СОП она стабильно позволяет получать воду требуемого качества. На этой фазе валидации выявляются любые изменения качества исходной воды, которые могут повлиять на работу системы и, в конечном итоге, непосредственно на качество воды. Отбор проб проводится по обычным процедурам и графику. Для систем подготовки воды для инъекций пробы следует отбирать ежедневно минимум из одной точки потребления и еженедельно контролировать все точки потребления. Валидация системы высокочистой воды считается завершенной после того, как предприятие накопит данные за календарный год.
Хотя приведенная выше схема влидации системы высокочистой воды не является единственно возможной, она включает необходимые элементы валидации системы водоподготовки. Во-первых, схема валидации должна включать данные, обосновывающие СОП. Во-вторых, она должна содержать данные, демонстрирующие, что все СОП эффективны и система в состоянии стабильно производит воду с показателями, установленными спецификацией. И, наконец, в схеме валидации должны быть представлены данные, которые демонстрируют, что сезонные изменения качества исходной воды не оказывают отрицательного влияния на работу системы высокочистой воды и на ее качество.
Последней частью валидации является представление собранных данных с заключениями в итоговом отчете. Итоговый валидационный отчет должен быть подписан лицами, отвечающими за эксплуатацию и обеспечение качества системы высокочистой воды.
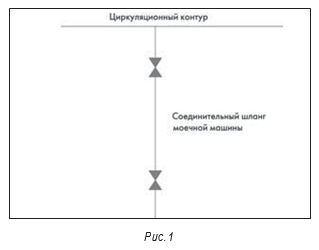
Типичная проблема, которая встречается на практике, – нарушение мероприятий по предотвращению загрязнения системы нестерильным воздухом, оставшимся в трубе после слива. На фрагменте системы, представленной на рис. 1, данная проблема возникает тогда, когда моечную машину или соединительный шланг промывают струей, а потом сливают воду после работы. После слива клапан (второй от системы) закрывают. Если на следующий день или при следующем включении открывают первый от циркуляционной системы высокочистой воды клапан, то оставшийся в трубе после слива нестерильный воздух загрязняет систему. Решение заключается в том, чтобы предусмотреть в СОП открывание второго клапана раньше первого для промывки системы перед использованием.
Еще одним важным моментом при валидации систем высокочистой воды являются критерии приемлемости. Стабильные результаты на всех участках системы высокочистой воды за весь период валидации являются первостепенными.
-
Уровни микробиологического загрязнения
Системы воды для инъекций
Согласно результатам микробиологического анализа воды для инъекций (ВДИ), предполагается, что она будет практически стерильной. Поскольку отбор проб часто производят в нестерильных зонах и не вполне асептическими методами, иногда возможен незначительный рост микроорганизмов в результате неправильного отбора проб. FDA считает уровень 10 КОЕ/100 мл приемлемым уровнем корректирующих действий. Ни один из уровней, устанавливаемых для оценки качества воды по данному показателю, не относится к типу «Соответствует/Не соответствует». Все они являются уровнями корректирующих действий. При превышении уровней корректирующих действий предприятие должно установить причину проблемы, предпринять действия по ее устранению, оценить влияние микробиологического загрязнения на произведенную с использованием этой воды продукцию и задокументировать результаты расследования.
Предпочтительный объем пробы для ВДИ по показателю «Микробиологическая чистота» составляет 100–300 мл. Пробы объемом менее 100 мл неприемлемы.
Реальную проблему для систем ВДИ представляют эндотоксины. Поскольку ВДИ может пройти ЛАЛ-тест на эндотоксины при превышении уровня корректирующего действия по микробиологической чистоте, важно осуществлять постоянный мониторинг систем ВДИ на содержание как эндотоксинов, так и микроорганизмов.
Системы воды очищенной
Требования по микробиологической чистоте для систем получения воды очищенной не столь очевидны. Требования Фармакопеи США (на момент подготовки этих руководящих указаний действующей является USP XXII), которые согласуются с требованиями федерального Управления по охране окружающей среды (Environmental Protection Agency – ЕРА) к питьевой воде, считаются минимальными. Некоторыми организациями предпринимались попытки установить более строгие требования для воды очищенной. Так, Ассоциация производителей косметических средств, туалетных принадлежностей и парфюмерии (CFTA,Cosmetic, Toiletry, and Fragrance Association) предложила установить требование – не более 500 микроорганизмов на миллилитр, а по Фармакопее США порог корректирующего действия составляет не более 100 микроорганизмов на один миллилитр». Хотя требования к микробиологической чистоте воды активно обсуждались, они так и не были введены в действие (за исключением стандартов ЕРА). Непосредственно FDA считает установление порога корректирующего действия выше 100 КОЕ/мл неприемлемым для системы воды очищенной.
Цель установления какого-либо предела или порога действия состоит в том, чтобы гарантировать, что система водоподготовки находится под контролем. Любой устанавливаемый порог корректирующего действия должен зависеть от системы воды очищенной в целом, дальнейшей технологии получения готовой продукции и ее применения. Например, в воде очищенной для производства лекарственных препаратов с помощью холодных технологий нежелательные микроорганизмы должны отсутствовать. Мы определяем термин «нежелательные микроорганизмы» как любые микроорганизмы, которые могут привести к инфицированию при применении лекарственного препарата в соответствии с инструкцией, или любой микроорганизм, способный к росту в лекарственном препарате. Как отмечено в руководящих указаниях по инспектированию микробиологических фармацевтических лабораторий контроля качества большее значение, как правило, имеет конкретный вид загрязнения, а не его уровень.
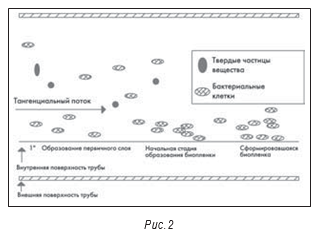
В системе воды очищенной микроорганизмы существуют во взвешенном состоянии или удерживаются на стенках труб и емкостей. Удерживаемые на стенках загрязнения такого типа образуют биопленки, от которых постоянно отделяются микроорганизмы. Таким образом, загрязнение распределено по системе неравномерно, и проба не обязательно отражает тип и уровень загрязнения. Вполне возможна ситуация, когда одна проба содержит 10 КОЕ/мл, а следующая 100 или даже 1000 КОЕ/мл.
Таким образом, при определении уровня загрязнения, допустимого в системе воды очищенной, используемой в производстве нестерильных препаратов, требуется понимание применения получаемого препарата, его состава (системы консервации) и технологии производства. Например, для изготовления антацидных препаратов, не содержащих эффективных консервантов, требуется порог корректирующих действий не более 100 КОЕ/мл.
Фармакопея США (USP) приводит некоторые рекомендации в фармакопейной монографии по микробиологическим показателям нестерильных препаратов. Там указывается, что «значимость микроорганизмов в нестерильных фармацевтических препаратах следует оценивать с точки зрения применения препарата, его природы и потенциального вреда для потребителя». Таким образом, проблему представляют не просто индикаторные микроорганизмы, указанные в конкретных фармакопейных статьях. Каждый производитель сам должен оценить свой продукт и технологию его производства, и на основании производимого с использованием этой воды препарата, представляющего наивысший риск, установить для своей системы воды очищенной допустимый порог корректирующего действия по микробиологическому загрязнению, не превышающий установленный максимум.
-
Системы воды для инъекций
При оценке и анализе систем воды для инъекций есть несколько аспектов, требующих особого внимания.
Предварительная очистка питающей (исходной) воды рекомендуется большинством производителей дистилляционного оборудования и, безусловно, она необходима для установок обратного осмоса. В течение срока эксплуатации системы водоподготовки качество поступающей исходной воды может меняться в зависимости от сезонных колебаний и иных внешних факторов, не зависящих от деятельности фармацевтического предприятия. Например, весной отмечено увеличение грамотрицательных микроорганизмов в воде. Новое строительство или пожары могут приводить к истощению запасов воды в старых водопроводных сетях, что может вызывать приток сильно загрязненной воды с различной флорой.
Конструкция системы воды для инъекций должна быть рассчитана на работу в таких прогнозируемых экстремальных условиях и ситуациях. Очевидно, единственный способ выявить такие экстремальные условия и ситуации – проводить периодический мониторинг исходной воды. Если питающая вода поступает из городского водопровода, вместо собственного анализа параметров качества могут использоваться данные подразделений муниципального контроля.
-
Дистиллятор
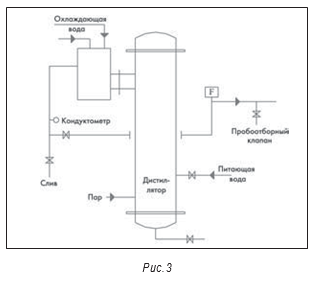
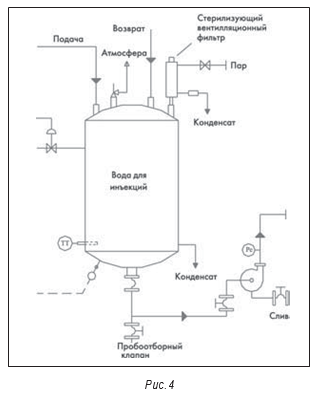
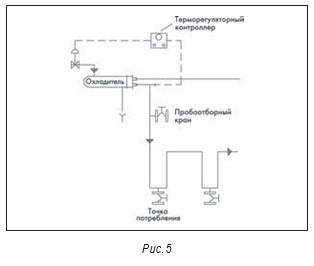
На рис. 3–5 показана типичная принципиальная схема системы ВДИ. В большинстве новых систем сейчас используются многоколоночные дистилляторы. На некоторых предприятиях отмечено загрязнение получаемой ВДИ эндотоксинами. В одной системе это произошло из-за неполадок в работе клапана питающей воды и контроля уровня воды в дистилляторе, что привело к попаданию капелек питающей воды в дистиллят.
В другом случае было отмечено, что при включении дистиллятора в конденсаторе уже было около 50 литров ВДИ. Поскольку вода могла находиться там не один день, например, в течение выходных, то это и явилось причиной недопустимого содержания эндотоксинов в получаемой ВДИ.
Однако чаще проблема заключается в том, что предварительная очистка исходной воды не обеспечивает необходимого снижения уровня эндотоксинов. Многие производители дистилляторов гарантируют снижение содержания эндотоксинов только на 2,5–3 log. Поэтому неудивительно, что в системах, где в исходной воде иногда бывают скачки до 250 МЕ/мл, в дистилляте (ВДИ) иногда отмечается недопустимый уровень эндотоксинов. Например, в трех новых дистилляторах, в том числе двух многоколоночных, недавно было выявлено периодическое повышение эндотоксинов в ВДИ выше 0,25 МЕ/мл. Системы предварительной очистки для этих дистилляторов включали только системы деионизации без ультрафильтрации, обратного осмоса или дистилляции. При отсутствии необходимой системы предварительной подготовки воды компании будет очень трудно доказать, что система ВДИ валидирована.
Приведенные выше примеры проблем с дистилляционными установками, используемыми для получения ВДИ, указывают на проблемы с обслуживанием оборудования или ненадлежащую его работу, что свидетельствует о том, что система не была должным образом валидирована, или что проведенная валидация уже не действительна. При обнаружении проблем такого рода следует очень тщательно проанализировать конструктивное решение системы, любые внесенные в систему изменения, валидационный отчет и данные регулярных испытаний и тестов, чтобы определить, что эксплуатация системы находится под контролем.
Обычно для мониторинга качества воды по химическим показателям в системах водоподготовки используются кондуктометры. Но они не дают информации о микробиологической чистоте.
На рис. 3–5 также показаны маленькие пробоотборные вентили между отдельными единицами оборудования, например, после дистиллятора и перед баком-накопителем. Они разделяют основные единицы оборудования. Это необходимо для квалификации оборудования и для изучения любых проблем, которые могут возникнуть.
-
Дистиллятор
Одним из основных компонентов дистиллятора является теплообменник. Из-за схожего ионного состава дистиллированной и деионизованной воды кондуктометры не могут использоваться для мониторинга ее микробиологической чистоты. Для предотвращения возможного загрязнения дистиллята питающей водой в имеющем течи теплообменнике следует использовать избыточное давление, как в случае применения термокомпрессионных дистилляторов или дистилляторов с «классической» двойной трубной решеткой «double tubesheet».
В техническом руководстве для инспекторов FDA «Теплообменники для предотвращения загрязнения» обсуждается конструкция теплообменников и возможные проблемы, связанные с использованием такого оборудования. В руководстве указывается, что есть два метода предотвращения загрязнения в результате течей. Первый заключается в установке манометров для постоянного мониторинга перепадов давления, чтобы более высокое давление всегда было с «чистой» стороны, а второй – в использовании теплообменников с двойными трубными решетками.
В некоторых системах теплообменники используются для охлаждения воды в точках потребления. Как правило, когда потребления воды нет, охлаждающая вода в них не циркулирует. Отмечено несколько случаев образования в трубах микроотверстий после того, как из них была слита охлаждающая вода, и они не использовались. Было установлено, что небольшое количество оставшейся в трубах влаги в сочетании с воздухом привело к коррозии труб из нержавеющей стали со стороны охлаждающей воды. Поэтому рекомендуется не сливать охлаждающую воду из теплообменников, когда они не используются.
-
Емкости для хранения
В системах «горячего» хранения воды температура обычно поддерживается подачей тепла в рубашку накопительной емкости или установкой в линии циркуляции воды теплообменника перед возвратом в накопительную емкость с теплоизоляцией.
Элементом накопительной емкости, вызывающим больше всего вопросов, является фильтр дыхания. Для контроля работы существует программа проверки целостности фильтров дыхания, подтверждающая его исправность. В настоящее время фильтры обычно снабжают рубашкой, чтобы конденсат или вода не закупоривали гидрофобный фильтр. Если это происходит (фильтр закупоривается), возможно нарушение целостности фильтра или бака. Существуют методы проверки целостности фильтров дыхания без демонтажа (in situ).
Поэтому необходимо помнить, что расположение фильтра дыхания на накопительной емкости должно обеспечивать легкий доступ к нему.
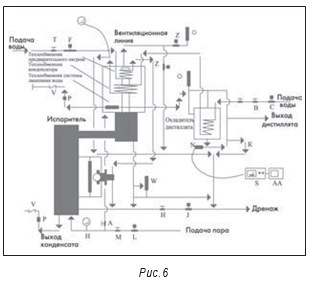
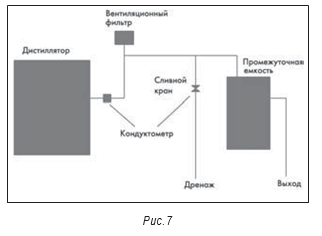
Сама по себе относительная новизна установки получения ВДИ и применение дистилляции как метода получения ВДИ не означают отсутствия проблем. При инспекции производителя парентеральных препаратов внимание привлекла установка 1984 года изготовления (см. рис. 6). При кажущейся сложности системы она оказалась относительно простой. На рис. 7 приведена схема установки. Среди замечаний по итогам инспекции было отмечено следующее: «Стандартные операционные процедуры по эксплуатации установки получения воды для инъекций (СОП) не обеспечивают периодической полной промывки или полного дренирования/опорожнения. Установка также контактирует с атмосферой и воздухом помещения. Оборудование для приготовления растворов лекарственных средств представляет собой негерметичные, открытые емкости с крышками. Накопительная емкость воды для инъекций также негерметична, из нее никогда не брали пробы на содержание бактериальных эндотоксинов». Из-за этих и других замечаний предприятие было вынуждено отозвать несколько препаратов и остановить производство.
-
Насосы
Насосы могут сгорать, а детали – изнашиваться. Кроме того, в случае не используемого постоянно насоса для создания статического давления накопительная емкость является застойной зоной. Например, в ходе инспекции было отмечено, что предприятию пришлось установить слив в нижней точке корпуса насоса. В системе хранения и распределения воды периодически обнаруживалось загрязнение Pseudomonas sp., что было отчасти отнесено на счет насоса, который эксплуатировался только периодически.
-
Трубопроводы
Трубопроводы систем ВДИ обычно изготавливаются из зеркально полированной стали. В некоторых случаях производители начали использовать трубы из поливинилиденфторида (ПВДФ). Считается, что при высокой температуре такие трубы не выделяют экстрагируемых веществ. Существенной проблемой при использовании трубопроводов из ПВДФ является необходимость обеспечения соответствующей поддержки трубопроводов за счет достаточно частого расположения опор для крепления. При нагреве трубы из ПВДФ она провисает, и в месте соединения может возникнуть напряжение, приводящее к протечке и/или разрыву. Кроме того, по меньшей мере в первоначальный период эксплуатации таких полимерных систем отмечается высокий уровень фторидов в воде. Такие трубы хороши в системах подачи продукта, когда незначительное загрязнение металлами может ускорять разложение лекарственного препарата, например, на биотехнологических производствах.
Распространенной проблемой с трубопроводами являются тупиковые зоны (dead legs). В предложенных Правилах производства парентеральных растворов больших объемов (LVP, Large volume parenterals) тупиковые зоны определяются как имеющие неиспользуемый участок длиной более шести диаметров неиспользуемой трубы при измерении от оси используемой трубы. Следует отметить, что это касается горячих (75–80°С) циркуляционных систем. В более холодных (65–75°С) системах в любых опусках или неиспользуемых участках трубы любой длины может образовываться биопленка, поэтому их следует по возможности исключить или предусмотреть специальные процедуры дезинфекции. В системах получения, хранения и распределения воды для фармацевтических целей недопустимо использование резьбовых соединений. Для соединений труб должны использоваться только санитарные разъемы или сварка встык. Санитарные разъемы обычно используются в местах соединения трубопроводов с клапанами, емкостями и иным оборудованием, которое необходимо демонтировать для обслуживания или замены. Поэтому во время инспекции следует проверять и оценивать процедуры санитарной обработки (дезинфекции) и сами трубопроводы.
-
Обратный осмос
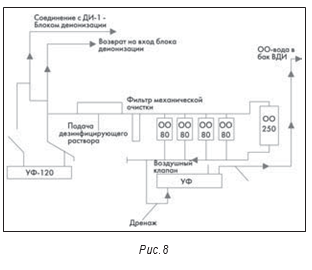
Другим допустимым методом получения ВДИ является обратный осмос (ОО). Однако, поскольку эти системы относятся к холодным, а ОО-мембраны не являются абсолютными, нередки случаи микробиологического загрязнения. На рис. 8 показана система, работавшая несколько лет назад. Система включает пять соединенных параллельно установок обратного осмоса. Поскольку ОО-мембраны не абсолютны, их производители рекомендовали последовательно устанавливать не менее двух мембран. На рисунке также показан ультрафиолетовый (УФ) облучатель, установленный в системе ниже установок обратного осмоса. Он потребовался для контроля снижения микробиологического загрязнения получаемой воды.
В системе также есть шаровые краны. Эти краны не считаются санитарными, потому что в середине крана есть полость и при его закрывании там может оставаться вода. Эта застойная зона, в которой могут присутствовать микроорганизмы, может инициировать начало образования биопленки.
Дополнительно следует отметить, что, понимая микробиологические проблемы в системах обратного осмоса, некоторые производители устанавливают сразу после ОО-фильтров теплообменники, нагревающие воду до 75-80°С для минимизации микробиологического загрязнения.
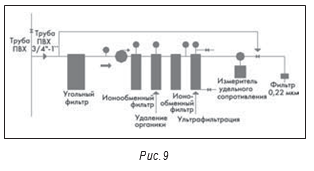
С появлением биотехнологических препаратов множество небольших предприятий стали использовать для получения высокочистой воды комбинированные системы обратного осмоса и ультрафильтрации. Например, на рис. 9 показана настенная система, запитываемая от одноступенчатой установки обратного осмоса.
Как и на рисунке 9, в большинстве подобных систем используются трубы из ПВХ или другого пластика. Так как эти системы обычно «холодные», их многочисленные соединения также являются потенциальным источником загрязнений. Другой, не менее серьезной проблемой при использовании пластиков являются экстрагируемые, в частности из ПВХ труб, вещества. Рассмотрение возможности соответствия системы ВДИ, выполненной из такого материала, на соответствие требованиям USP без какого-либо подтверждения отсутствия экстрагируемых веществ просто неприемлемо.
В точках отбора ВДИ в системах ее распределения установлены фильтры 0,2 микрона, которые могут скрывать истинную картину уровня микробиологического загрязнения системы. Известно, что главной опасностью в таких системах водоподготовки являются эндотоксины; при этом стерилизующий фильтр снижает микробиологическое загрязнение, но не обязательно удаляет эндотоксины. Если в системах распределения воды для фармацевтических целей используются фильтры, то для каждого фильтра должно быть указано его назначение, т.е. либо удаление механических примесей, либо снижение микробиологического загрязнения, а также должна быть в СОП, в которой указывается периодичность замены фильтра, основанная на данных, полученных при валидации системы.
Как говорилось выше, из-за объема реально анализируемой воды (0,1 мл при определении эндотоксинов по сравнению со 100 мл при анализе общего микробного числа ВДИ) микробиологический анализ дает хорошее представление об уровне загрязнения системы. Поэтому проведение микробиологического анализа не имеет особого смысла, если проба воды отбирается перед конечным фильтром 0,2 микрона
При повторной инспекции этого биотехнологического производства было отмечено, что для устранения недостатков системы ВДИ были выполнены работы по монтажу трубопроводов системы распределения из нержавеющей стали, в которые вода поступала из четырех последовательно смонтированных установок обратного осмоса. Поскольку этому производителю не требовалось для нужд производства много воды (общая производительность системы составляла около 115 литров), они попытались отключить систему примерно на сутки. На рис. 9 показано, что в точке отсчета (в 9 часов третьего октября) микроорганизмы и эндотоксины в обнаруживаемых количествах отсутствовали. Через день было выявлено загрязнение этой статичной системы, вода в которой не циркулировала. Четыре пробы, взятые с интервалом в один час, также иллюстрируют вариабельность полученных результатов отобранных из системы проб. После отбора последней пробы в 12 часов систему повторно продезинфицировали 0,5%-ным раствором перекиси водорода, промыли, включили рециркуляцию и отобрали повторные пробы. После повторного включения системы микробиологическое загрязнение в ежедневных пробах отсутствовало. По этой причине FDA рекомендовало ежедневно сливать воду из нерециркулирующих/ тупиковых систем, а не оставлять ее в системе.
-
Системы воды очищенной
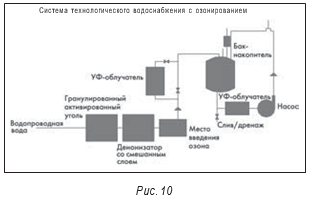
Многие комментарии в отношении оборудования для систем получения воды для инъекций применимы и к системам воды очищенной. В одном типе систем, используемых для контроля микробиологического загрязнения, используется озон. На рис. 10 показана стандартная система с использованием озонирования. Хотя эта система считается относительно недорогой, с ней связан ряд проблем. Для оптимальной эффективности требуется, чтобы в системе оставался растворенный остаточный озон. В результате возникают проблемы как с безопасностью персонала, так и с использованием воды при приготовлении препаратов.
Опубликованные данные производственной компании Vicks в г. Гринсборо, Северная Каролина, показали, что их система оказалась повторно загрязненной через два–три дня после выключения генератора озона. При инспектировании другого производителя была отмечена проблема с загрязнением Peudomonas sp. Из-за возможных проблем с безопасностью персонала перед подачей воды в рециркуляционную систему из нее удаляли озон. Имеются сообщения, что растворенный озон в концентрации 0,45 мг/л остается в системе не более пяти–шести часов.
Еще один производитель в рамках ежедневной санитарной обработки снимает все опуски озонированной воды и дезинфицирует их в 70%-ном изопропиловом спирте, прошедшем стерилизующую фильтрацию. В отчетах у этого производителя великолепные результаты по микробиологии. Однако пробы отбирают только сразу после дезинфекции, а не в конце работы. Поэтому результаты не вполне показательны.
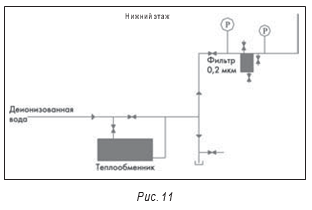
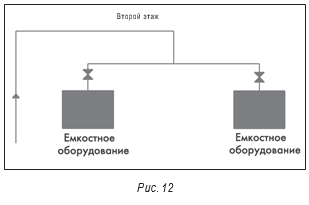
На рисунках 11 и 12 представлена еще одна система воды очищенной, в которой были отмечены проблемы. В отличие от большинства других вышеописанных систем эта система не рециркуляционная, а тупиковая. Для еженедельной дезинфекции системы путем нагрева воды и используется теплообменник. Фактически, вся эта система является тупиковой.
На рис. 11 показан установленный в линии фильтр 0,2 микрона, используемый для ежедневной дезинфекции очищенной воды. Помимо того, что корпус фильтра – хорошая среда для микробиологического загрязнения, типичной проблемой является гидравлический удар, который приводит к «раздуванию» фильтра. Если расположенный ниже фильтра кран закрыть слишком быстро, обратное давление воды может привести именно к таким проблемам. Типичным видимым признаком высокого обратного давления является вибрация трубы, но действительная проблема заключается в попадании находившихся выше стерилизующего фильтра загрязнений на лицевую сторону фильтра. Эта система также имеет несколько вертикальных отводов к точкам потребления. Во время дезинфекции важно приоткрывать оконечные краны, чтобы все колена и изгибы трубопроводов наполнились водой и таким образом полностью подверглись воздействию дезинфицирующего средства.
Следует отметить, что эта система не является неадекватной только из-за того, что она тупиковая. При хорошо отработанных и написанных стандартных операционных процедурах, основанных на данных валидации, и регулярных обработках горячей водой, эта система может быть приемлемой. Соответствующей требованиям была сочтена даже очень длинная (более 180 метров) система с более чем 50 точками потребления. Все опуски этой системы ежедневно промывали водой, нагретой до 80°С.
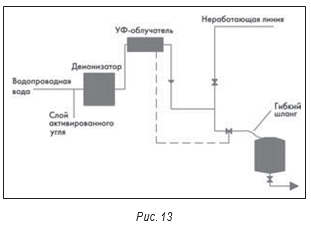
Последняя система воды очищенной, рассматриваемая ниже, была признана несоответствующей требованиям. Обнаруженная в системе (после анализа, проведенного FDA) Pseudomonas sp. была найдена и в местнодействующем стероидном препарате (после анализа, проведенного FDA). В результате продукция была отозвана из продажи, и FDA выпустило письмо-предупреждение. Эта система (рис. 13) тоже тупиковая с использованием УФ-облучателя для контроля микробиологического загрязнения. Облучатель включают, только когда нужна вода.
Таким образом, бывают периоды, когда вода остается в системе трубопроводов и застаивается. Гибкий шланг, который также используется в данной схеме, очень трудно продезинфицировать. Чтобы УФ-облучатели работали, их нужно правильно обслуживать. Стеклянные кожухи вокруг ламп(-ы) должны быть чистыми, иначе их эффективность снижается. В установках с несколькими лампами должна быть система, позволяющая определить, что все лампы работают. Нужно помнить, что УФ-облучение убивает не более 90% поступающих в установку организмов.
-
Технологическая вода
В настоящее время Фармакопея США (USP) на стр. 4 в разделе общих замечаний разрешает производство лекарственных субстанций из питьевой воды. В то же время там указывается, что любые готовые формы должны производиться из воды очищенной, воды для инъекций или одной из форм стерильной воды. В этих утверждениях есть определенная непоследовательность, потому что для гранулирования таблеточной смеси нужно использовать воду очищенную, однако для финальной очистки лекарственной субстанции допускается использование и питьевой воды.
В Руководстве FDA по инспектированию фармацевтических ингредиентов ангро выражается озабоченность качеством воды, используемой для производства лекарственных субстанций, особенно лекарственных субстанций для парентеральных препаратов. Отмечаются случаи повышенного микробиологического и/или эндотоксинового загрязнения лекарственных субстанций, источником которых является используемая при очистке вода. В настоящее время на финишных этапах синтеза/очистки лекарственных субстанций для парентерального применения не обязательно использовать воду для инъекций. Однако те системы воды, которые используются или планируются к использованию на финишных стадиях производства лекарственных субстанций для парентерального применения, для гарантии обеспечения минимального эндотоксинового/микробиологического загрязнения следует валидировать.
На производствах лекарственных субстанций, особенно для производства парентеральных лекарственных средств, для получения воды распространены системы ультрафильтрации и обратного осмоса (ОО). Хотя ультрафильтрация не вполне эффективно снижает общий уровень пирогенов, но зато снижает содержание в воде эндотоксинов с высокой молекулярной массой. Как и ОО, ультрафильтрация не является «абсолютным» процессом, но гарантировано улучшает показатели на порядки. Кроме того, как говорилось раньше о других холодных системах, для поддержания их работоспособности требуется постоянное техническое обслуживание и существенные эксплуатационные затраты.
При производстве лекарственных субстанций не для парентерального применения все равно существуют вопросы микробиологической чистоты, хотя и в меньшей степени, чем для лекарственных субстанций для парентерального применения. В некоторых регионах мира питьевая (хлорированная) вода может не представлять проблемы с точки зрения микробиологии. Однако могут возникнуть другие вопросы. Например, использование хлорированной воды обычно приводит к повышению содержания хлоридов, содержание которых в воде для фармацевтических целей регламентируется и которые влияют на удельную электропроводность воды. В некоторых регионах вода для нужд технологии может быть получена непосредственно из источника водоснабжения.
В рамках проведения одной из инспекций производителя, получавшего воду для технологических нужд из реки в сельскохозяйственном районе, было выявлено, что в какой-то момент у них возникла проблема с повышенным содержанием пестицидов, попадавших в воду из расположенных рядом ферм. Процесс производства и методы анализа не были рассчитаны на удаление и идентификацию следовых загрязнений пестицидами. Поэтому очевидно, что использование такой схемы технологической воды для очистки лекарственных субстанций недопустимо.
-
Технологическая вода
Обычно у производителей бывают периодические записи (журналы, распечатки или таблицы) с результатами данных по системам водоподготовки. Эти данные должны быть проанализированы. Кроме того, следует проанализировать отчеты о расследованиях случаев превышения установленных пределов.
Поскольку результаты микробиологических анализов воды из системы водоподготовки не могут быть получены сразу после изготовления лекарственного препарата, результаты превышения установленных пределов следует рассматривать с учетом того, что продукт произведен с использованием воды такого качества. Решение о дальнейшей переработке или выпуске такого продукта зависит от вида загрязнения, технологии и конечного использования продукта. Такие ситуации обычно рассматриваются для каждого конкретного случая. В таких ситуациях правильно прилагать к отчету компании отчет о расследовании таких случаев с обоснованием выпуска/забраковки. Результаты микробиологического анализа конечного продукта, хотя и дают определенную информацию, не должны служить единственным основанием для выпуска лекарственного препарата. Следует учитывать ограничения при отборе проб и микробиологического анализа (объемы проб, время и пр.).
У производителей также должны быть записи или журналы обслуживания оборудования, например, дистилляторов. Эти журналы также следует анализировать, чтобы можно было оценить проблемы с системой и оборудованием.
Помимо рассмотрения результатов анализа, сводных данных, отчетов о расследованиях и иных данных при проведении физической инспекции следует рассматривать и схемы системы водоподготовки (P&ID). Как указывалось выше, чтобы продемонстрировать, что система валидирована, нужны правильное ее описание и достоверная схема.
Редакция выражает глубокую признательность Генеральному директору ООО «Фармсистемы» Приходько Александру за помощь в подготовке текста статьи к опубликованию